Bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion...
Bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo: Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
Giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo:
- Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
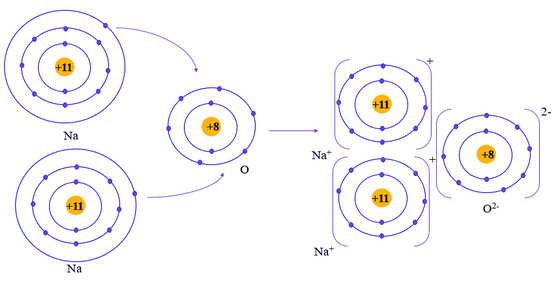
- Hai ion Na+ và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O.
Trên đây Khối A đã hướng dẫn các em giải bài 5 trang 58 SGK Hoá 10 Chân trời sáng tạo. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
• Xem hướng dẫn giải bài tập Hoá 10 Chân trời sáng tạo
® Lý thuyết Hoá 10 Sách giáo khoa (SGK) Chân trời sáng tạo có thể bạn muốn xem
» Bài 2: Thành phần của nguyên tử
» Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
» Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
» Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
» Bài 10: Liên kết cộng hóa trị
» Bài 11: Liên kết hydrogen và tương tác van der waals
» Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
» Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
» Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
» Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
» Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
» Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo




































