Cách viết cấu hình Electron, Nguyên lý bền vững, nguyên lý Pauli và quy tắc Hund, Orbital nguyên tử - Hoá 10 bài 4
Cấu trúc lớp vỏ Electron của nguyên tử là nội dung bài 4 Hoá 10 SGK Chân trời sáng tạo. Sau đây là tóm tắt ngắn gọn, đầy đủ và dễ hiểu bài Cấu trúc lớp vỏ Electron của nguyên tử để các em thuận tiện tham khảo.
Bài này sẽ giúp các em biết Cách viết cấu hình Electron, nội dung Nguyên lý bền vững, nguyên lý Pauli và quy tắc Hund, khái niệm Orbital nguyên tử, lớp và phân lớp electron nguyên tử,...
I. Sự chuyển động của electron trong nguyên tử
1. Sự chuyển động của electron trong nguyên tử
- Theo mô hình nguyên tử của Rutherford – Bohr (mô hình hành tinh nguyên tử), các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
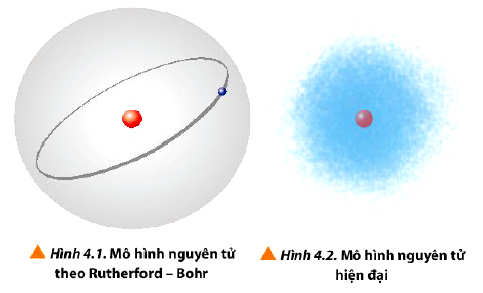
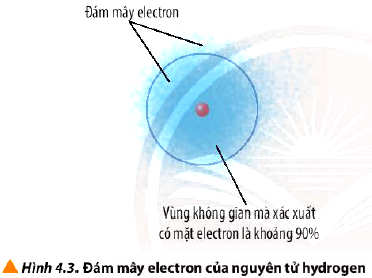
- Theo mô hình hiện đại, trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
2. Orbital nguyên tử
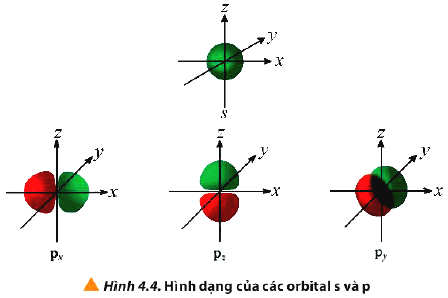
- Orbital nguyên tử (Atomic Orbital, viết tắt là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
- Một số AO thường gặp: s, p, d, f
- Các AO có hình dạng khác nhau: AO s có dạng hình cầu, AO p có dạng hình số tám nổi, AO d và f có hình dạng phức tạp.
II. Lớp và phân lớp electron
Trong nguyên tử, các electron được sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
1. Lớp electron
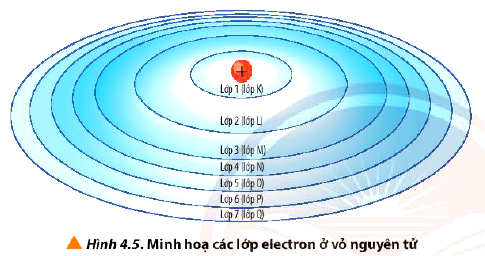
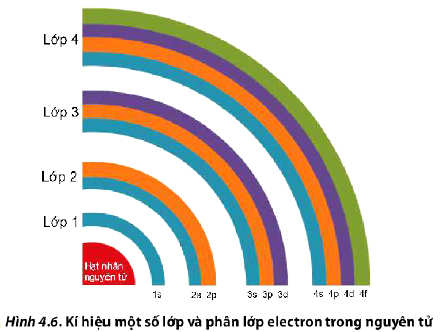
- Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K, L, M, N, O, P, Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n = 1 đến n = 7.
- Các electron trên cùng một lớp có năng lượng gần bằng nhau.
2. Phân lớp electron
- Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái viết thường: s, p, d, f. Các electron thuộc các phân lớp s, p, d và f được gọi tương ứng là các electron s, p, d và f.
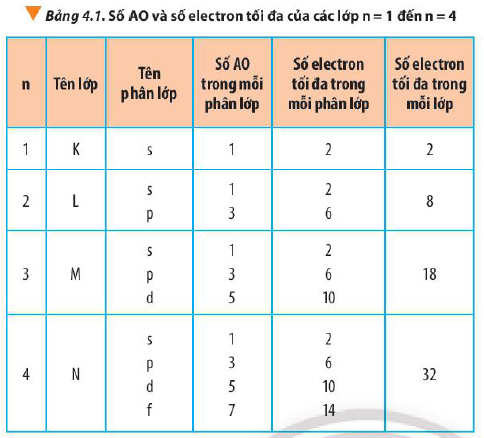
- Các phân lớp s, p, d và f lần lượt có các số AO tương ứng 1, 3, 5 và 7.
- Các electron trên cùng một phân lớp có năng lượng bằng nhau.
- Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
* Ví dụ: Lớp thứ 3 có 3 phân lớp. Lớp thứ 4 có 4 phân lớp.
III. Cấu hình electron nguyên tử
1. Nguyên lí vững bền
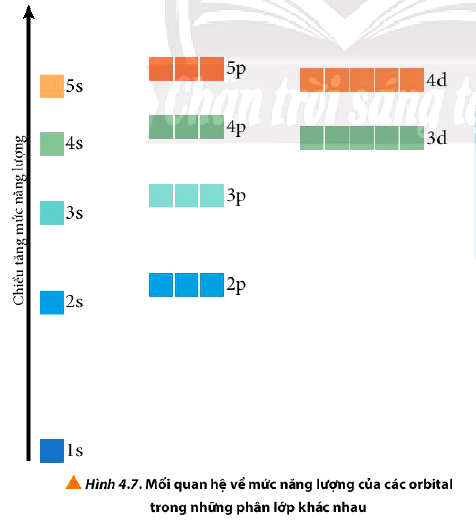
- Trong nguyên tử, các electron trên mỗi AO có một mức năng lượng xác định. Người ta gọi mức năng lượng này là mức năng lượng AO nguyên tử.
- Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p...
- Các electron trên các AO khác nhau của cùng một phân lớp có năng lượng như nhau.
* Ví dụ: Phân lớp 3p có 3 AO 3px, 3py, 3pz; các electron của các AO p trong phân lớp này tuy có sự định hướng trong không gian khác nhau nhưng chúng có cùng mức năng lượng AO.
2. Nguyên lí Pauli
- Để biểu diễn orbital nguyên tử, người ta sử dụng các ô vuông, gọi là ô lượng tử. Mỗi ô lượng tử ứng với một AO. Mỗi AO chứa tối đa 2 electron.
+ Nếu trong AO chỉ chứa 1 electron thì electron đó gọi là electron độc thân (kí hiệu bởi 1 mũi tên hướng lên ↑).
+ Nếu AO chứa đủ 2 electron thì các electron đó gọi là electron ghép đôi (kí hiệu bởi hai mũi tên ngược chiều nhau ↑↓).
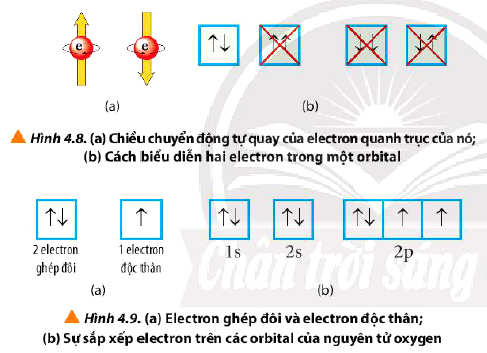
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
- Dựa vào nguyên lí Pauli, ta dễ dàng xác định được số AO và số electron tối đa trong mỗi lớp và phân lớp:
+ Số AO tối đa trong lớp n là n2 (n ≤ 4).
+ Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
* Ví dụ: Số AO tối đa trong lớp thứ 2 là 22 = 4
Số electron tối đa trong lớp thứ 2 là 2.22 = 8 electron.
3. Quy tắc Hund
- Các phân lớp: s2; p6; d10; f14 chứa đủ số electron tối đa gọi là phân lớp bão hòa.
- Các phân lớp: s1; p3; d5; f7 chứa một nửa số electron tối đa gọi là phân lớp nửa bão hòa.
- Các phân lớp chưa đủ số electron tối đa gọi là phân lớp chưa bão hòa.
- Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
4. Cách viết cấu hình electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trong vỏ nguyên tử trên các phân lớp thuộc các lớp khác nhau.
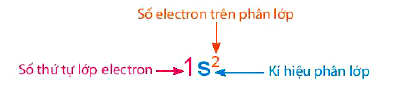
- Cấu hình electron nguyên tử phải được viết theo thứ tự các lớp electron và phân lớp trong mỗi lớp. Trong đó:
+ Số thứ tự lớp electron được viết bằng các số tự nhiên (n = 1, 2, 3, …)
+ Phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f.
+ Số electron của từng phân lớp được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp.
- Quy ước cách biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp như sau:
• Cách viết cấu hình electron:
+ Bước 1: Xác định số electron của nguyên tử.
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong nguyên tử.
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron.
* Ví dụ: Ca (Z = 20): Thứ tự mức năng lượng orbital: 1s22s22p63s23p64s2.
Cấu hình electron: 1s22s22p63s23p64s2 hoặc viết gọn là: [Ar]4s2.
[Ar] là kí hiệu cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước Ca.
Cấu hình electron theo orbital của Ca: ![]()
5. Đặc điểm electron lớp ngoài cùng của nguyên tử
- Dựa vào số lượng electron lớp ngoài cùng của nguyên tử nguyên tố, có thể dự đoán một nguyên tố là kim loại, phi kim hay khí hiếm.
+ Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại (trừ H, He, B).
+ Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim.
+ Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
+ Các nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm (trừ He có 2 electron ở lớp ngoài cùng).
Trên đây KhoiA.Vn đã giới thiệu với các em về Cách viết cấu hình Electron, Nguyên lý bền vững, nguyên lý Pauli và quy tắc Hund, Orbital nguyên tử - Hóa 10 bài 4 SGK Chân trời sáng tạo. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
® Lý thuyết Hoá 10 Sách giáo khoa (SGK) Chân trời sáng tạo có thể bạn muốn xem
» Bài 2: Thành phần của nguyên tử
» Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
» Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
» Bài 10: Liên kết cộng hóa trị
» Bài 11: Liên kết hydrogen và tương tác van der waals
» Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
» Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
» Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
» Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
» Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
» Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
» Bài 18: Hydrogen halide và một số phản ứng của ion halide
• Xem hướng dẫn giải bài tập SGK Hoá 10 Chân trời sáng tạo
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo




































