Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì và trong một nhóm - Hoá 10 bài 6
Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm là nội dung bài 6 Hoá 10 SGK Chân trời sáng tạo. Sau đây là tóm tắt ngắn gọn, đầy đủ và dễ hiểu bài này để các em thuận tiện tham khảo.
Bài này sẽ giúp các em biết xu hướng biến đổi bán kính nguyên tử; xu hướng biến đổi độ âm điện; xu hướng biến đổi tính kim loại, tính phi kim theo nhóm; Và xu hướng biến đổi tính acid base của oxide và hydroxide theo chu kì,...
I. Xu hướng biến đổi bán kính nguyên tử
- Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
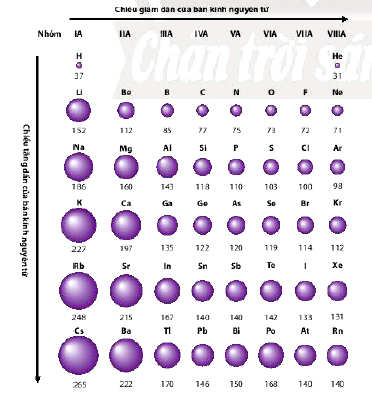
+ Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
+ Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
II. Xu hướng biến đổi độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
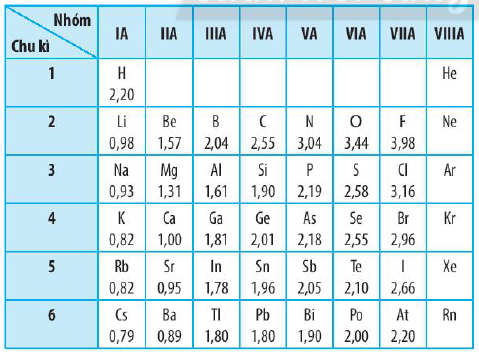
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
III. Xu hướng biến đổi tính kim loại, tính phi kim
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
* Ví dụ: Na → Na+ + 1e
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron.
* Ví dụ: F + 1e → F-
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
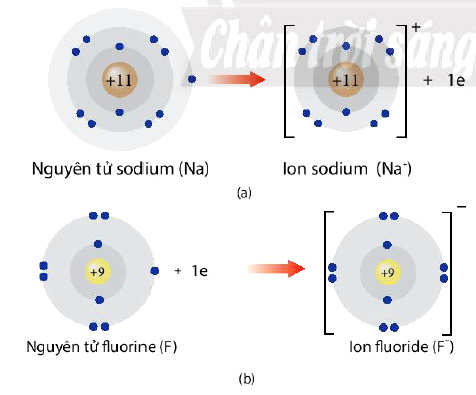 Quá trình nhường nhận electron của nguyên tử Sodiu và fluorine
Quá trình nhường nhận electron của nguyên tử Sodiu và fluorine
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
IV. Xu hướng biến đổi tính acid – base của oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
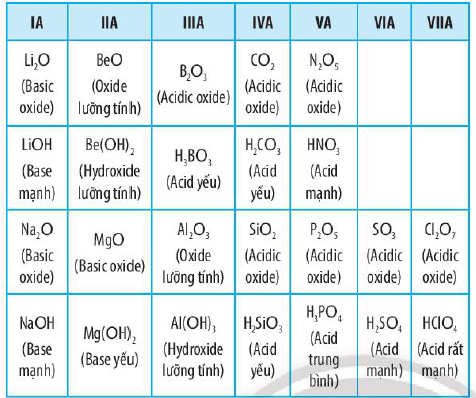 Tính axit - base của oxide và hydroxide tương ứng của các nguyên tố thuộc chu kỳ 2 và 3
Tính axit - base của oxide và hydroxide tương ứng của các nguyên tố thuộc chu kỳ 2 và 3
Trên đây KhoiA.Vn đã giới thiệu với các em về Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì và trong một nhóm - Hóa 10 bài 6 SGK Chân trời sáng tạo. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
® Lý thuyết Hoá 10 Sách giáo khoa (SGK) Chân trời sáng tạo có thể bạn muốn xem
» Bài 2: Thành phần của nguyên tử
» Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
» Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
» Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
» Bài 10: Liên kết cộng hóa trị
» Bài 11: Liên kết hydrogen và tương tác van der waals
» Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
» Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
» Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
» Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
» Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
» Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
» Bài 18: Hydrogen halide và một số phản ứng của ion halide
• Xem hướng dẫn giải bài tập SGK Hoá 10 Chân trời sáng tạo
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo




































