Thí nghiệm Thomson, Rutherford, sự tìm ra Electron, Proton và Neutron kích thước và khối lượng nguyên tử - Hoá 10 bài 2
Thành phần của nguyên tử là nội dung bài 2 Hoá 10 SGK Chân trời sáng tạo. Sau đây là tóm tắt ngắn gọn, đầy đủ và dễ hiểu bài Thành phần của nguyên tử để các em thuận tiện tham khảo.
Bài này sẽ giúp các em hiểu về cấu tạo của nguyên tử, cấu tạo hạt nhân nguyên tử, thí nghiệm của Thomson, Thí nghiệm của Rutherford, sự tìm ra electron, sự xuất hiện của Proton và Neutron, kích thước và khối lượng của nguyên tử,...
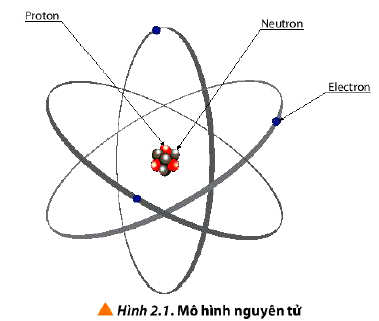
1. Thành phần cấu tạo nguyên tử
Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
2. Sự tìm ra electron
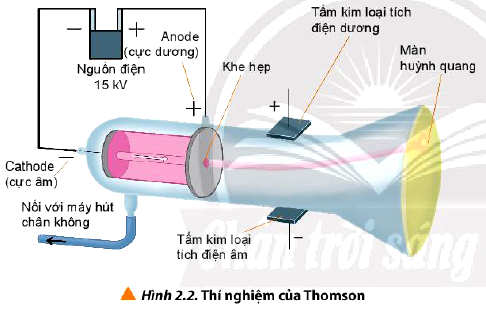
- Năm 1897, nhà vật lí người Anh J.J Thomson thực hiện thí nghiệm phóng điện qua một ống thủy tinh gần như chân không (gọi là ống tia âm cực). Ông quan sát thấy màn huỳnh quang trong ống phát sáng do những tia phát ra từ cực âm (gọi là tia âm cực) và những tia này bị hút về cực dương của trường điện, chứng tỏ chúng tích điện âm. Đó chính là chùm các hạt electron.
⇒ Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm, được gọi là electron.
- Hạt electron, kí hiệu là e, có:
+ Điện tích: qe = - 1,602.10-19 C (coulomb).
+ Khối lượng: me = 9,11.10-28g.
- Người ta chưa phát hiện được điện tích nào nhỏ hơn 1,602.10-19 C nên nó được dùng làm điện tích đơn vị, điện tích của electron được quy ước là -1.
3. Sự khám phá ra hạt nhân nguyên tử
- Năm 1911, nhà vật lí người New Zealand là E. Rutherford đã tiến hành bắn phá một chùm hạt alpha lên một lá vàng siêu mỏng và quan sát đường đi của chúng sau khi bắn phá bằng màn huỳnh quang.
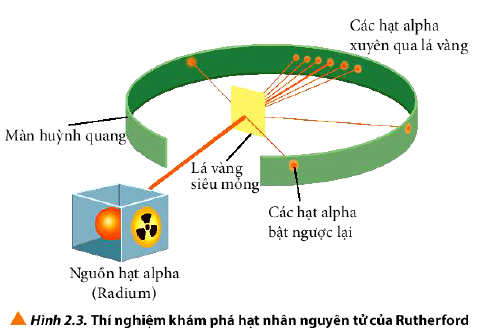
- Kết quả: Hầu hết các hạt alpha đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít hạt bật trở lại.
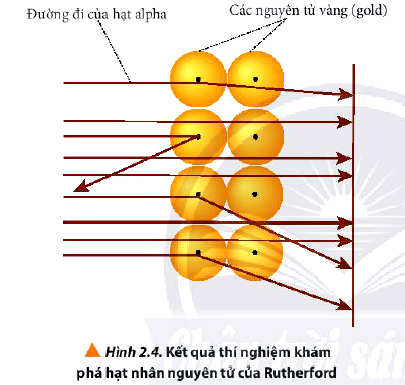
- Giải thích kết quả:
+ Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.
- Kết luận:
+ Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
+ Nguyên tử trung hòa về điện: số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
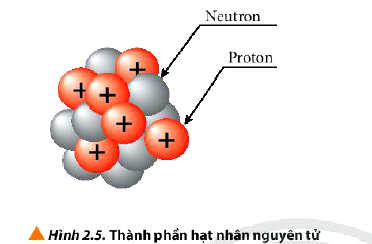
4. Cấu tạo hạt nhân nguyên tử
- Vào năm 1918, khi bắn phá hạt nhân nguyên tử nitrogen bằng các hạt α, Rutherford đã nhận thấy sự xuất hiện hạt nhân nguyên tử oxygen và một loại hạt mang một đơn vị điện tích dương (eo hay +1), đó là proton (kí hiệu là p).
- Năm 1932, khi dùng các hạt α để bắn phá hạt nhân nguyên tử beryllium, J. Chadwick nhận thấy sự xuất hiện của một loại hạt có khối lượng xấp xỉ hạt proton, nhưng không mang điện. Ông gọi chúng là neutron (kí hiệu là n).
- Kết luận: Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron.
+ Proton kí hiệu là p, mang điện tích dương (+1)
+ Neutron kí hiệu là n, không mang điện.
+ Proton và neutron có khối lượng gần bằng nhau.
5. Kích thước và khối lượng nguyên tử
a) Kích thước nguyên tử
- Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
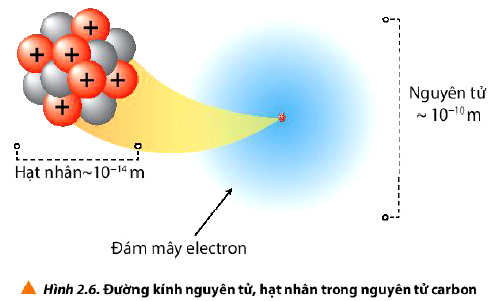
- Đơn vị nanomet (nm) hay angstrom () thường được sử dụng để biểu thị kích thước nguyên tử.
1nm=10−9m; 1 =10−10m;1nm=10
b) Khối lượng nguyên tử
- Để biểu thị khối lượng nguyên tử, các hạt proton, neutron và electron, người ta dùng đơn vị khối lượng nguyên tử, kí hiệu là amu.
1 amu bằng 1/12 khối lượng nguyên tử của carbon: 1 amu = 1,66.10-24g.
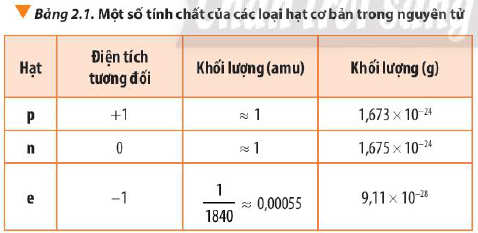
- Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron (me ≈ 0,00055 amu) không đáng kể so với khối lượng của proton (mp ≈ 1 amu) và neutron (mn ≈ 1 amu).
- Cách tính: Khối lượng nguyên tử = số p + số n
* Ví dụ: Nguyên tử oxygen có 8 proton, 8 neutron và 8 electron.
⇒ Khối lượng nguyên tử oxygen = số p + số n = 8 + 8 = 16 amu.
Trên đây KhoiA.Vn đã giới thiệu với các em về Thí nghiệm Thomson, Rutherford, sự tìm ra Electron, Proton và Neutron kích thước và khối lượng nguyên tử - Hóa 10 bài 2 SGK Chân trời sáng tạo. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
® Lý thuyết Hoá 10 Sách giáo khoa (SGK) Chân trời sáng tạo có thể bạn muốn xem
» Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
» Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
» Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
» Bài 10: Liên kết cộng hóa trị
» Bài 11: Liên kết hydrogen và tương tác van der waals
» Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
» Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
» Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
» Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
» Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
» Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
» Bài 18: Hydrogen halide và một số phản ứng của ion halide
• Xem hướng dẫn giải bài tập SGK Hoá 10 Chân trời sáng tạo
> Bài 4 trang 19 SGK Hoá 10 Chân trời sáng tạo: a) Cho biết 1 g electron có bao nhiêu hạt?...
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo




































