Công thức Lewis của SCl2 (Sulfur dichloride Lewis Structure)
Chi tiết hướng dẫn cách viết công thức Lewis của SCl2, công thức electron, công thức cấu tạo của các nguyên tố hóa học theo SGK mới dễ hiểu.
Sau đây là cách viết công thức Lewis của SCl2 (Sulfur dichloride Lewis Structure) được hướng dẫn cụ thể, chi tiết từng bước và dễ hiểu để các bạn tham khảo.
1. Viết công thức Lewis của SCl2 (theo công thức phân tử và electron hoá trị)
Thực hiện lần lượt theo các bước sau:
• Bước 1: Tính tổng số electron hóa trị trong phân tử
S có 6 electron hóa trị, Cl có 7 electron hóa trị. Trong phân tử SCl2 có 1 nguyên tử S, 2 nguyên tử Cl
Tổng số electron hóa trị trong phân tử SCl2 = 6 + 7.2 = 20.
• Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
(Lưu ý: chọn nguyên tử trung tâm là nguyên tử có độ âm điện nhỏ hơn hay nguyên tử cần nhiều electron hơn để đạt octet)
Trong phân tử SCl2, nguyên tử S cần 2 electron để đạt octet, nguyên tử Cl cần 1 electron hóa trị để đạt octet. Do đó, nguyên tử S phải là nguyên tử trung tâm của SCl2.
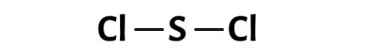
• Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị đã dùng để xây dựng khung là: 2.2 = 4 electron
Số electron hóa trị còn lại là: 20 – 4 = 16 electron
Sử dụng số electron hoá trị còn lại (16 electron) để tạo octet cho Cl trước (do Cl có độ âm điện cao hơn) S:
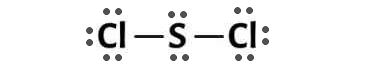 Bây giờ, ta có số electron hóa trị không còn dư mà tất cả các nguyên tử đã đạt được quy tắc octet.
Bây giờ, ta có số electron hóa trị không còn dư mà tất cả các nguyên tử đã đạt được quy tắc octet.
Vậy công thức Lewis của SCl2 là:
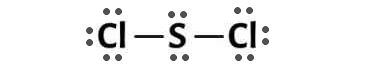
2. Công thức Electron của SCl2
Sự hình thành phân tử SCl2:
Nguyên tử S có 6 electron hóa trị, cần thêm 2 electron để đạt octet
Nguyên tử Cl có 7 electron hóa trị, cần thêm 1 electron để đạt octet.
Khi hình thành phân tử SCl2, nguyên tử S góp chung với mỗi nguyên tử Cl một electron để tạo thành 1 cặp electron dùng chung, vì có hai nguyên tử Cl nên có tất cả 2 cặp electron dùng chung giữa S và Cl.
Công thức electron của SCl2 là:
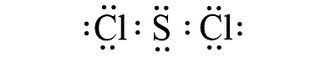
* Nhận xét:
+ Phân tử SCl2 có 2 cặp electron dùng chung và có 2 cặp electron tự do ở nguyên tử S, mỗi nguyên tử Cl còn 3 cặp electron tự do.
3. Viết công thức Lewis của SCl2 (dựa vào công thức electron)
Từ công thức electron, thay mỗi cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của SCl2, thay mỗi cặp electron bằng một gạch nối. Ta được:
Công thức Lewis của SCl2 là:
4. Công thức cấu tạo của SCl2 (Sulfur dichloride)
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
Công thức cấu tạo của SCl2 là:
* Nhận xét:
+ Phân tử SCl2 chỉ gồm liên kết đơn.
+ Phân tử SCl2 có cấu trúc góc.
» Hãy xem để hiểu thêm về cách viết cấu trúc Lewis
| Công thức Lewis của: | ||||
| SO2 | SO3 | N2 | NH3 | NO2 |
| HNO3 | H2SO4 | CH4 | H3PO4 | HBr |
| H2CO3 | H2SO3 | HCl | H2S | C2H4 |
| C2H2 | CO2 | CO | NO | N2O3 |
| H3O+ | NO3- | PCl3 | P2O5 | Cl2O7 |
| Cl2 | H2 | O2 | H2O2 | H2O |
| CH3CHO | CH3COOH | CH3OH | SCl2 | CS2 |
| CCl4 | ||||
Trên đây KhoiA.Vn đã hướng dẫn các em Cách viết công thức Lewis của SCl2 (Sulfur dichloride Lewis Structure) Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo


































