Giải Hóa 10 Chân trời Sáng tạo trang 114
Chi tiết lời giải Hóa 10 Chân trời sáng tạo Trang 114 bài 18: Hydrogen Halide và một số phản ứng của ion halide cực dễ hiểu để các em tham khảo giải bài tập SGK Hóa 10 Chân trời sáng tạo nhanh, chính xác và đạt kết quả cao hơn.
Mở đầu trang 114 Hóa 10 Chân trời sáng tạo:
Thủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản. Trước đây, muốn khắc các hoa văn, cần phủ lên bề mặt thủy tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phần thủy tinh cần khắc lộ ra.
Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phần thủy tinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoa văn trên vật dụng cần trang trí. Quá trình ăn mòn thủy tinh xảy ra thế nào? Các ion halide có tính chất gì?

Lời giải:
- Hydrofluoric acid (HF) là acid rất yếu, nhưng có tính chất đặc biệt là ăn mòn thủy tinh, phương trình hóa học của phản ứng ăn mòn thủy tinh:
SiO2 + 4HF → SiF4↑ + 2H2O
- Tính chất của các ion halide: Trong ion halide, các halogen có số oxi hóa thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa – khử.
+ Tính khử của các ion halide tăng theo chiều: F- < Cl- < Br- < I-
+ Ví dụ: Ion bromide khử H2SO4 đặc thành SO2 và Br- bị oxi hóa thành Br2, sản phẩm có màu vàng đậm.
Câu hỏi 1 trang 114 Hóa 10 Chân trời sáng tạo:
Dựa vào Bảng 18.1 và Hình 18.1, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào?
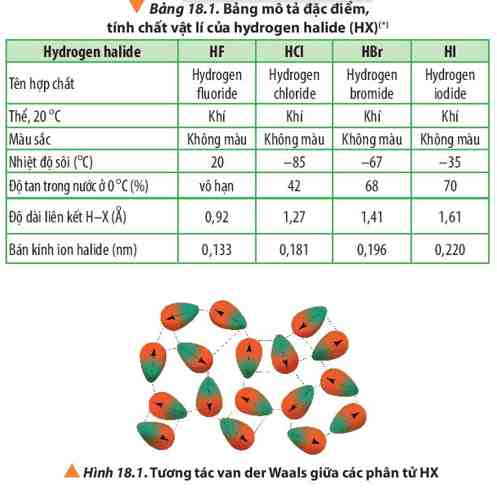
Lời giải:
- Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI.
- Giải thích: Khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.
Lời giải bài tập Hóa học lớp 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide Chân trời sáng tạo hay khác:
Trên đây KhoiA.Vn đã hướng dẫn các em Giải Hóa 10 Chân trời Sáng tạo trang 114. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
• Xem thêm giải bài tập Hóa 10 Chân trời sáng tạo
> Giải Hóa 10 Chân trời Sáng tạo trang 114
> Giải Hóa 10 Chân trời Sáng tạo trang 115
> Giải Hóa 10 Chân trời Sáng tạo trang 116
> Giải Hóa 10 Chân trời Sáng tạo trang 117
> Giải Hóa 10 Chân trời Sáng tạo trang 118
> Giải Hóa 10 Chân trời Sáng tạo trang 119
Đánh giá & nhận xét
- Tìm m để đường thẳng tiếp xúc với đường tròn Toán 10 - Hỏi nhanh đáp gọn
- Đơn vị Micro, Nano, Pico? Bảng mẫu đơn vị về ước số và bội số trong SI? Hỏi đáp môn Vật lí
- Hệ đơn vị SI là gì? 7 đơn vị cơ bản của hệ SI? Hỏi nhanh đáp gọn môn Vật lí
- Giải hệ phương trình bằng quy tắc Cramer, Phương pháp định thức Cramer lớp 10
- Phương trình bậc 2 có đúng 1 nghiệm dương khi nào? Điều kiện PT bậc 2 có đúng 1 nghiệm dương - Toán lớp 10
- Giải Vật lí 10 trang 92 Chân trời Sáng tạo
- Giải Vật lí 10 trang 91 Chân trời Sáng tạo
- Giải Vật lí 10 trang 90 Chân trời Sáng tạo
- Giải Vật lí 10 trang 89 Chân trời Sáng tạo
- Giải Vật lí 10 trang 88 Chân trời Sáng tạo




































