Bài tập về Axit Cacbonic Muối Cacbonat: Giải bài 1, 2, 3, 4, 5 trang 91 SGK Hóa 9 bài 29
Sau khi học xong nội dung lý thuyết về trạng thái tự nhiên, tính chất vật lí và tính chất hóa học của axit cacbonic; phân loại và tính chất của muối cacbonat.
Dưới đây là các bài tập vận dụng tính chất vật lí và tính chất hóa học của axit cacbonic; phân loại và tính chất của muối cacbonat để các em tham khảo.
* Bài 1 trang 91 SGK Hóa học 9: Hãy lấy ví dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền.
> Lời giải:
- Axit HCl tác dụng với muối cacbonat tạo thành axit cacbonic.
2HCl + Na2CO3 → 2NaCl + H2CO3
- Axit cacbonic H2CO3 là axit không bền, bị phân hủy ngay cho CO2 và H2O nên phương trình được viết là:
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
* Bài 2 trang 91 SGK Hóa học 9: Dựa vào tính chất hóa học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hóa học minh họa.
> Lời giải:
¤ Magie cacbonat MgCO3 có tính chất của muối cacbonat.
- Tác dụng với dung dịch axit:
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O.
- MgCO3 không tan trong nước, không tác dụng với dung dịch muối và dung dịch bazơ.
- Dễ bị phân hủy:
MgCO3 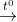 MgO + CO2.
MgO + CO2.
* Bài 3 trang 91 SGK Hóa học 9: Viết các phương trình hóa học biểu diễn chuyển hóa sau:
> Lời giải:
- Các phương trình phản ứng hóa học:
(1): C + O2 CO2↑
(2): CO2 + Ca(OH)2 → CaCO3↓trắng + H2O
(3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
* Bài 4 trang 91 SGK Hóa học 9: Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3
b) K2CO3 và NaCl
c) MgCO3 và HCl
d) CaCl2 và Na2CO3
e) Ba(OH)2 và K2CO3
> Lời giải:
- Những cặp chất tác dụng với nhau:
a) H2SO4 + 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
c) MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
d) CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
e) Ba(OH)2 + K2CO3 → BaCO3 ↓ + 2KOH
- Cặp chất không tác dụng với nhau: b). K2CO3 và NaCl
* Lưu ý: Điều kiện của phản ứng trao đổi trong dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa (không tan) hoặc chất chất khí tạo thành.
* Bài 5 trang 91 SGK Hóa học 9: Hãy tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980g H2SO4 tác dụng hết với dung dịch NaHCO3.
> Lời giải:
- Theo bài ra, ta có: nH2SO4 = 980/98 = 10(mol).
- Phương trình hóa học của phản ứng:
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2H2O
- Theo phương trình phản ứng:
nCO2 = 2.nH2SO4 = 10.2 = 20 (mol).
- Thể tích khí cacbonic tạo thành (đktc), từ công thức:
n=V/22,4 ⇒ VCO2 = n.22,4 = 20.22,4 = 448 (lít).
Nếu có nhận xét về nội dung phần Bài tập về Axit Cacbonic Muối Cacbonat: Giải bài 1, 2, 3, 4, 5 trang 91 SGK Hóa 9 ở trên, các em hãy để lại ở phần bình luận dưới bài viết nhé, KhoiA.Vn chúc các em thành công.
Đánh giá & nhận xét
- Tìm giá trị nhỏ nhất, giá trị lớn nhất của tam thức bậc 2
- Tìm giá trị nhỏ nhất, giá trị lớn nhất của biểu thức chứa trị tuyệt đối
- Tìm giá trị nhỏ nhất (gtnn), giá trị lớn nhất (gtln) của biểu thức lớp 9
- Tìm giá trị nhỏ nhất, giá trị lớn nhất của biểu thức chứa dấu căn
- Cách chứng minh 3 điểm thẳng hàng Toán lớp 9
- Cách giải phương trình chứa ẩn ở mẫu lớp 9, phương trình chứa ẩn ở mẫu là gì?
- Cách giải phương trình tích lớp 9, phương trình tích là gì?
- Đường thẳng cắt parabol tại 2 điểm khi nào? Tìm m để d cắt P tại hai điểm thỏa điều kiện
- Số tiếp tuyến chung của hai đường tròn cắt nhau, ở ngoài nhau, tiếp xúc ngoài, tiếp xúc trong?
- Hai đường tròn cắt nhau có bao nhiêu tiếp tuyến chung?


































