Bài tập Kim loại kiềm thổ và hợp chất của kim loại kiềm thổ: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8, 9 trang 118, 119 SGK Hóa 12 bài 26
Sau khi tìm hiểu về kim loại kiềm thổ và các hợp chất quan trọng của kim loại kiềm thổ; các em đã biết vị trí của kim loại kiềm thổ trong bảng tuần hoàn, cấu tạo nguyên tử, tính chất vật lí, tính chất hóa học và phương pháp điều chế kim loại kiềm thổ. Biết tính chất vật lí, hóa học và ứng dụng của một số hợp chất quan trọng của kim loại kiềm thổ. Biết thế nào là nước cứng, nguyên tắc và phương pháp làm mềm nước cứng.
Nội dung bài viết này các em sẽ vận dụng kiến thức lý thuyết ở trên để giải một số bài tập Kim loại kiềm thổ và hợp chất của kim loại kiềm thổ: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8, 9 trang 118, 119 SGK Hóa 12 bài 26, qua đó rèn luyện được kỹ năng giải bài tập đồng thời giúp ghi nhớ kiến thức lý thuyết tốt hơn.
* Bài 1 trang 118 SGK Hóa 12: Xếp các kim loại kiềm thổ theo chiều tăng dần điện tích hạt nhân thì:
A. bán kính nguyên tử giảm dần.
B. năng lượng ion hóa giảm dần.
C. tính khử giảm dần.
D. khả năng tác dụng với nước giảm dần.
> Lời giải:
• Chọn đáp án: B. năng lượng ion hóa giảm dần.
* Bài 2 trang 119 SGK Hóa 12: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không có hiện tượng gì.
> Lời giải:
• Chọn đáp án: A.Có kết tủa trắng.
- PTPƯ: Ca(OH)2 + Ca(HCO3)2 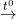 2CaCO3 + H2O
2CaCO3 + H2O
* Bài 3 trang 119 SGK Hóa 12: Cho 2,84 g hỗn hợp CaCO3 và MgCO3 tác dụng hết với dung dịch HCl thấy bay ra 672 ml khí CO2 (đktc). Phần trăm khối lượng của hai muối (CaCO3 , MgCO3) trong hỗn hợp là :
A. 35,2 % và 64,8%.
B. 70,4% và 29,6%.
C. 85,49% và 14,51%.
D. 17,6% và 82,4%.
> Lời giải:
• Chọn đáp án: B.70,4% và 29,6%.
- Gọi x, y lần lượt là số mol của CaCO3 và MgCO3 trong hỗn hợp
ta có: 100x + 84y = 2,84 (1)
- Phương trình hoá học của phản ứng:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
x (mol) x
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
y (mol) y
- Theo bài ra, Số mol CO2:
nCO2 = 0,672/22,4 = 0,03 (mol)
- Theo PTPƯ: nCO2 = x + y = 0,3 (2)
- Giải hệ PT (1) và (2) ta được: x = 0,02 (mol) và y = 0,01 (mol)
⇒ %mCaCO3 = [(0,02.100)/2,84].100% = 70,42%
⇒ %mMgCO3 = 100% - 70,42% = 29,58%
* Bài 4 trang 119 SGK Hóa 12: Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
A. Be. B. Mg.
C. Ca. D. Ba.
> Lời giải:
• Chọn đáp án: C. Ca
- Gọi M là kim loại nhóm II, số mol là x, ta có: Mx = 2 (1)
- Phương trình hoá học của phản ứng:
M + 2HCl → MCl2 + H2↑
x (mol) x
- Theo PTPƯ ta có: (71+M)x = 5,55 (2)
- Giải hệ PT (1) và (2) ta được: x = 0,05 và M = 40
⇒ M là Ca
* Bài 5 trang 119 SGK Hóa 12: Cho 2,8 g CaO tác dụng với một lượng nước lấy dư thu được dung dịch A. Sục 1,68 lít CO2(đktc) vào dung dịch A.
a) Tính khối lượng kết tủa thu được.
b) Khi đun nóng dung dịch A thì khối lượng kết tủa thu được tối đa là bao nhiêu?
> Lời giải:
a) Theo bài ra, ta có số mol CaO là: nCaO = 2,8/56 = 0,05 (mol)
Số mol CO2 là nCO2 = 1,68/22,4 = 0,075 (mol)
- Phương trình hoá học của phản ứng:
CaO + H2O → Ca(OH)2
0,05 (mol) 0,05 (mol)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,05 0,05 0,05 (mol)
- Theo PTPƯ: nCaCO3 = nCO2 pư = nCa(OH)2 = 0,05 mol
⇒ nCO2 dư = 0,075 – 0,05 = 0,025 (mol)
- CaCO3 tạo thành 0,05 (mol) bị hòa tan 0,025 (mol)
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,025 0,025 0,025 (mol)
⇒ Số mol CaCO3 còn lại là: 0,05 – 0,025 = 0,025 (mol)
⇒ Khối lượng CaCO3 là:
mCaCO3 = 0,025. 100 = 2,5 (g)
b) Khi đun nóng dung dịch A
Ca(HCO3)2 ![]() CaCO3↓ + CO2 + H2O
CaCO3↓ + CO2 + H2O
0,025 0,025 (mol)
⇒ Khối lượng kết tủa tối đa thu được là:
mCaCO3 = (0,025 + 0,025).100 = 5 (g)
* Bài 6 trang 119 SGK Hóa 12: Khi lấy 14,25g muối clorua của một kim loại chỉ có hóa trị II và một lượng muối nitrat của kim loại đó có số mol bằng số mol muối clorua thì thấy khác nhau 7,95g. Xác định tên kim loại
> Lời giải:
- Gọi kim loại cần tìm là M, có hóa trị là II
⇒ Công thức muối clorua là MCl2, có số mol là x
Ta có PT: (M + 71)x = 14,25 (1)
⇒ Công thức muối nitrat là M(NO3)2.
Ta có PT: (M + 124)x = 14,25 + 7,95 (2)
- Giải hệ PT (1) và (2) ta được, x = 0,15, M = 24
⇒ M là Mg
* Bài 7 trang 119 SGK Hóa 12: Hòa tan 8,2 gam hỗn hợp bột CaCO3 và MgCO3 trong nước cần 2,016 lít CO2 (đktc). Xác định số gam mỗi muối trong hỗn hợp.
> Lời giải:
- Gọi x, y lần lượt là số mol CaCO3 và MgCO3 trong hỗn hợp
⇒ 100x + 84y = 8,2 (1)
- Theo bài ra, ta có: nCO2 = 2,016/22,4=0,09 (mol)
- Phương trình hoá học của phản ứng:
CaCO3 + CO2 + H2O → Ca(HCO3)2
x x (mol)
MgCO3 + CO2 + H2O → Mg(HCO3)2
y y (mol)
- Theo PTPƯ: nCO2 = x + y = 0,09 (2)
- Giải hệ PT gồm (1) và (2) ta được, x = 0,04 và y = 0,05
⇒ mCaCO3 = 0,04.100 = 4 (g)
⇒ mMgCO3 = 0,05.84 = 4,2 (g)
* Bài 8 trang 119 SGK Hóa 12: Trong một cốc nước có chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3-, 0,02 mol Cl-. Nước trong cốc thuộc loại nào ?
A. Nước cứng có tính cứng tạm thời.
B. Nước cứng có tính cứng vĩnh cửu.
C. Nước cứng có tính cứng toàn phần.
> Lời giải:
• Chọn đáp án: C. Nước cứng có tính cứng toàn phần.
- Cốc nước trên chứa các ion: Ca2+, Mg2+, HCO3-, Cl-
⇒ Thuộc nước cứng toàn phần (có cả tính cứng tạm thời và tính cứng vĩnh cửu)
* Bài 9 trang 119 SGK Hóa 12: Viết phương trình hóa học của phản ứng để giải thích việc dùng Na3PO4 để làm mềm nước cứng có tính cứng toàn phần.
> Lời giải:
- Các phương trình hoá học của phản ứng
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
3CaSO4 +2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4.
- Khi đó tất cả các ion Ca2+, Mg2+ đều kết tủa hết dưới dạng muối photphat => làm mềm được nước cứng toàn phần.
Trên đây KhoiA.Vn đã hướng dẫn các em cách giải một số Bài tập Kim loại kiềm thổ và hợp chất của kim loại kiềm thổ: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8, 9 trang 118, 119 SGK Hóa 12 trong nội dung bài học 36. Hy vọng bài viết giúp các em hiểu rõ hơn. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết, chúc các em thành công.
Đánh giá & nhận xét
- Cách chứng minh 3 vectơ KHÔNG đồng phẳng trong Oxyz lớp 12
- Cách tìm m để 3 vectơ đồng phẳng trong Oxyz lớp 12
- 3 vectơ đồng phẳng trong Oxyz khi nào, điều kiện 3 vectơ đồng phẳng lớp 12
- Viết phương trình parabol đi qua các điểm cực trị? Hỏi nhanh đáp gọn môn Toán
- Giải Địa lí 12 trang 23 Chân trời Sáng tạo
- Giải Địa lí 12 trang 27 Chân trời Sáng tạo
- Giải Địa lí 12 trang 26 Chân trời Sáng tạo
- Giải Địa lí 12 trang 25 Chân trời Sáng tạo
- Giải Địa lí 12 trang 22 Chân trời Sáng tạo
- Giải Địa lí 12 trang 21 Chân trời Sáng tạo


































