Tính chất vật lý của Sắt (Fe), tính chất hóa học của Sắt và Trạng thái tự nhiên của Sắt - Hóa 12 bài 31
Sắt (Fe) là một trong những kim loại rất phổ biến trong đời sống và sản xuất. Sắt chiếm khoảng 5% khối lượng vỏ trái đất, đứng hàng thứ hai trong các kim loại (sau nhôm). Trong tự nhiên, sắt tồn tại chủ yếu ở dạng hợp chất.
Bài viết này sẽ giúp các em biết vị trí của sắt trong bảng tuần hoàn, cấu hình electron nguyên tử của sắt (Fe). Tính chất vật lý, tính chất hóa học của sắt và trạng thái tự nhiên của sắt.
I. Vị trí của sắt trong bảng tuần hoàn, cấu hình electron nguyên tử của Fe
Sắt (Fe) ở ô số 26, thuộc nhóm VIIIB, chu kì 4 của bảng tuần hoàn.
Cấu hình electron nguyên tử :
1s22s22p63s23p63d64s2, có thể viết gọn là [Ar]3d64s2.
Nguyên tử sắt dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d trở thành ion Fe3+.
II. Tính chất vật lý của sắt (Fe)
- Sắt là kim loại có màu trắng hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, có D = 7,9 g/cm3.
- Sắt có tính dẫn điện, dẫn nhiệt tốt, đặc biệt có tính nhiễm từ.
III. Tính chất hóa học của Sắt Fe
- Tác dụng với phi kim
- Tác dụng với axit
- Tác dụng với muối
- Tác dụng với nước
- Sắt có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
- Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
1. Sắt tác dụng với phi kim
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
a) Sắt tác dụng với lưu huỳnh (Fe + S)
- Khi đun nóng, Fe khử S xuống số oxi hóa -2, còn sắt bị oxi hóa đến số oxi hóa +2.
b) Sắt tác dụng với oxi (Fe + O2)
- Khi đun nóng, Fe khử O2 đến số oxi hóa -2, còn Fe bị oxi hóa đến số oxi hóa +2 và +3.
3Fe + 2O2 Fe3O4
c) Sắt tác dụng với clo (Fe + Cl2)
Fe khử Cl2 đến số oxi hóa -1, còn Fe bị oxi hóa đến số oxi hóa +3.
2. Sắt tác dụng với axit
a) Sắt tác dụng với dung dịch HCl, H2SO4 loãng
Fe khử ion H+ của các dung dịch HCl, H2SO4 loãng thành H2, Fe bị oxi hóa đến số oxi hóa +2.
b) Sắt tác dụng với dung dịch HNO3 và H2SO4 đặc, nóng
Fe khử N+5 hoặc S+6 trong dung dịch HNO3 hoặc H2SO4 đặc, nóng đến số oxi hóa thấp hơn, còn Fe bị oxi hóa đến số oxi hóa +3.
> Lưu ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
3. Sắt tác dụng với dung dịch muối
- Sắt có thể khử được ion của các kim loại đứng sau nó trong dãy điện hóa của kim loại.
4. Sắt tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước.
Ở nhiệt độ cao sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O Fe3O4 + 4H2↑
Fe + H2O FeO + H2↑
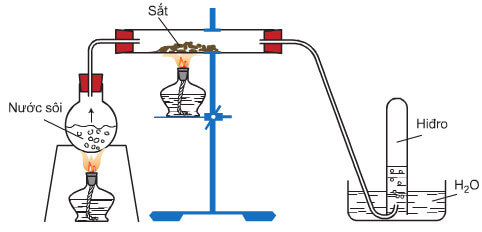 Sắt khử hơi nước ở nhiệt độ cao
Sắt khử hơi nước ở nhiệt độ cao
IV. Trạng thái tự nhiên
- Sắt chiếm 5% khối lượng vỏ Trái Đất, đứng thứ hai trong các kim loại (sau nhôm).
- Sắt tồn tại chủ yếu ở dạng hợp chất.
Quặng sắt quan trọng là: quặng manhetit (Fe3O4) (hiếm có trong tự nhiên), quặng hematit đỏ (Fe2O3), quặng hematit nâu (Fe2O3.nH2O), quặng xiđerit (FeCO3), quặng pirit (FeS2).
- Sắt có trong hemoglobin (huyết cầu tố) của máu, làm nhiệm vụ vận chuyển oxi, duy trì sự sống.
- Những thiên thạch từ khoảng không của Vũ Trụ rơi vào Trái Đất có chứa sắt tự do.
Trên đây KhoiA.Vn đã giới thiệu với các em về Tính chất vật lý của Sắt (Fe), tính chất hóa học của Sắt và Trạng thái tự nhiên của Sắt . Hy vọng bài viết giúp các em hiểu rõ hơn. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết, chúc các em thành công.
• Xem hướng dẫn giải bài tập Hoá học 12
> Bài 1 trang 141 SGK Hóa 12: Các kim loại nào sau đây đều phản ứng với dung dịch CuCl2?
> Bài 2 trang 141 SGK Hóa 12: Cấu hình electron nào sau đây là của Fe3+?...
Đánh giá & nhận xét
- Cách chứng minh 3 vectơ KHÔNG đồng phẳng trong Oxyz lớp 12
- Cách tìm m để 3 vectơ đồng phẳng trong Oxyz lớp 12
- 3 vectơ đồng phẳng trong Oxyz khi nào, điều kiện 3 vectơ đồng phẳng lớp 12
- Viết phương trình parabol đi qua các điểm cực trị? Hỏi nhanh đáp gọn môn Toán
- Giải Địa lí 12 trang 23 Chân trời Sáng tạo
- Giải Địa lí 12 trang 27 Chân trời Sáng tạo
- Giải Địa lí 12 trang 26 Chân trời Sáng tạo
- Giải Địa lí 12 trang 25 Chân trời Sáng tạo
- Giải Địa lí 12 trang 22 Chân trời Sáng tạo
- Giải Địa lí 12 trang 21 Chân trời Sáng tạo


































