Benzen: Tính chất vật lý, tính chất hóa học của Benzen, Đồng đẳng và Ứng dụng hidrocacbon thơm - Hóa 11 bài 35
Benzen có công thức phân tử C6H6 có cấu trúc thẳng và có hình lục giác đều. Cả 6 nguyên tử cacbon và 6 nguyên tử hidro cùng nằm trên một mặt phẳng.
Nội dung bài viết này sẽ giúp các em hiểu rõ về cấu tạo của Benzen, tính chất vật lý, tính chất hóa học của benzen; đồng đẳng Toluen; Một số hidrocacbon thơm khác như Stiren, Naphtalen và ứng dụng.
I. Đồng đẳng, đồng phân, danh pháp, cấu tạo của benzen
1. Đồng đẳng của benzen
- Benzen C6H6 và các hiđrocacbon thơm khác có công thức phân tử là C7H8 (toluen), C8H10, lập thành dãy đồng đẳng có công thức phân tử chung CnH2n−6 (n ≥ 6).
2. Danh pháp
- Khi coi vòng benzen là mạch chính thì các nhóm ankyl đính với nó là mạch nhánh (còn gọi là nhóm thế).
- Tên gọi: Tên vị trí – tên nhánh + benzen
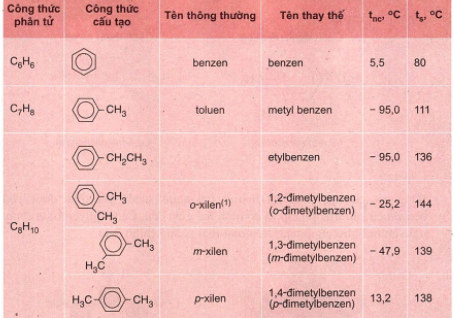
3. Cấu tạo của benzen
- Cấu trúc phân tử benzen: Sáu nguyên tử C trong phân tử liên kết với nhau tạo vòng 6 cạnh, 3 liên kết đôi tạo hệ liên hợp chung cho cả vòng benzen. Các nguyên tử trong phân tử cùng nằm trên mặt phẳng.
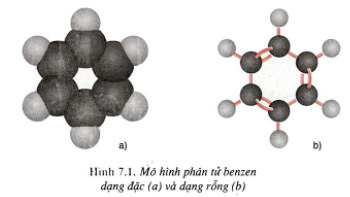
- Biểu diễn cấu tạo benzen: ![]()
II. Tính chất vật lý của benzen
- Bezen là chất lỏng, không màu, có mùi thơm đặc trưng, nhẹ hơn nước và không tan trong nước nhưng tan nhiều trong dung môi hữu cơ như rượu, ete, xeton
III. Tính chất hóa học của benzen
1. Phản ứng thế
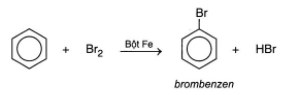
• Phản ứng thế H ở nhân thơm bởi các tác nhân như halogen X2/Fe; HNO3/H2SO4 đặc, tuân theo quy tắc thế vào vòng benzen.
- Phản ứng thế H của vòng benzen với Brom
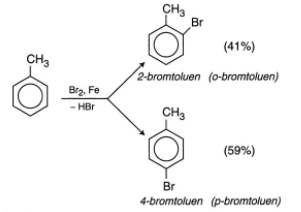
 - Phản ứng thế H của vòng ankylbenzen với Brom
- Phản ứng thế H của vòng ankylbenzen với Brom
- Phản ứng với axit nitric của benzen
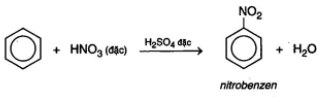
- Phản ứng với axit nitric của ankylbenzen, ví dụ:
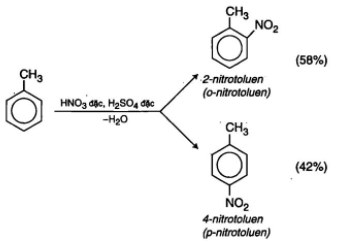
• Quy tắc thế vào vòng benzen:
- Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2,...) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
- Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
• Thế nguyên tử H ở mạch nhánh
- Nếu đun toluen hay các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
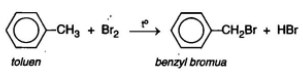
2. Phản ứng cộng:
a) Phản ứng cộng hidro của benzen
C6H6 + 3H2 C6H12 (xiclohexan)
b) Phản ứng cộng clo của benzen
C6H6 + 3Cl2 C6H6Cl6 (hexacloxiclohexan)
3. Phản ứng oxi hóa
a) Phản ứng oxi hóa không hoàn toàn
- Benzen không làm mất màu KMnO4
- Toluen làm mất màu dung dịch kali pemanganat (KMnO4) tạo kết tủa mangan đioxit (MnO2).
C6H5-CH3 + 2KMnO4 → C6H5COOK + 2MnO2↓ + KOH + H2O
b) Phản ứng oxi hóa hoàn toàn
- Phản ứng cháy tỏa nhiều nhiệt và cho nhiều muội than.
CnH2n-6 + [(3n-3)/2]O2 nCO2 + (n-3)H2O
IV. STIREN (hay: vinybenzen, phenyletilen)
• Cấu tạo và tính chất vật lý của Stiren
- Công thức phân tử của stiren: C8H8
- Công thức cấu tạo của stiren: 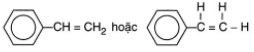
- Stiren là chất lỏng không màu, sôi ở 1460C, nhẹ hơn nước, không tan trong nước nhưng tan nhiều trong dung mỗi hữu cơ
• Tính chất hóa học của Stiren
- Tính chất thơm tương tự ankylbenzen: có phản ứng thế H ở nhân thơm, oxi hóa Cα ở nhánh.
- Tính chất không no của nhóm vinyl tương tự anken: cộng halogen, cộng hiđro halogenua, trùng hợp, làm mất màu dung dịch KMnO4.
- Stiren phản ứng với dung dịch brom:
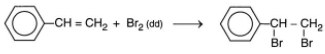
- Stiren phản ứng với hiđro: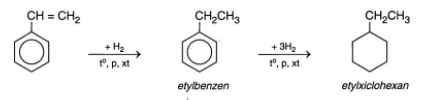
- Stiren phản ứng trùng hợp:
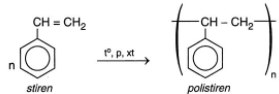
V. NAPHTALEN
• Công thức phân tử của Naphtalen: C10H8
• Công thức cấu tạo của Naphtalen 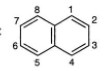
• Tính chất vật lý của Naphtalen
- Naphtalen là chất rắn màu trắng, thăng hoa ngay ở nhiệt độ thường, có mùi đặc trưng, không tan trong nước, tan trong dung môi hữu cơ.
• Tính chất hóa học của Naphtalen
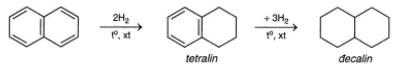
- Naphtalen có tính thơm tương tự benzen: Naphtalen tham gia từng phản ứng thế dễ dàng hơn benzen và thường ưu tiên thế nguyên tử H ở vị trí Cα (vị trí C số 1 của vòng), có phản ứng cộng H2/(Ni, to) tạo C10H12 (tralin) hoặc C10H18 (đecanlin).
- Phản ứng thế của naphtalen với brom
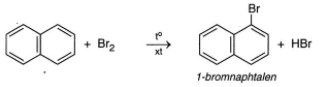
- Phản ứng thế với axit nitric của naphtalen
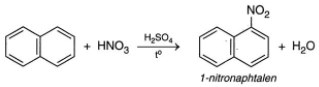
- Phản ứng cộng hidro của naphtalen
VI. Ứng dụng của một số hidrocacbon thơm
- Benzen và toluen là nguyên liệu rất quan trọng cho công nghiệp hoá học. Nguồn cung cấp benzen, toluen chủ yếu là từ nhựa than đá và từ sản phẩm đề hiđro đóng vòng hexan, heptan tương ứng.
Trên đây KhoiA.Vn đã giới thiệu với các em về Benzen: Tính chất vật lý, tính chất hóa học của Benzen, Đồng đẳng và Ứng dụng hidrocacbon thơm. Hy vọng bài viết giúp các em hiểu rõ hơn. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết, chúc các em thành công.
Đánh giá & nhận xét
- Bài 2 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 61 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 61 SGK Vật lí 11 Chân trời sáng tạo


































