Bài tập về Axit, Bazơ, Muối và Hidroxit lưỡng tính theo Areniut - Hóa 11 bài 2
Sau khi nắm được nội dung về Axit, Bazơ, Muối và Hidroxit lưỡng tính theo thuyết Areniut, nội dung bài này chúng ta sẽ vận dụng giải một số bài tập liên quan.
Dưới đây là một số hướng dẫn giải bài tập về axit, bazơ, muối và hidroxit lưỡng tính để các em tham khảo. Nội dung bài viết giải các bài tập 1, 2, 3, 4, 5 trang 10 SGK Hóa 11.
• Lý thuyết Axit, bazo, muối và hidroxit lưỡng tính theo Areniut - Hóa 11 bài 2
* Bài 1 trang 10 sgk hóa 11: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit? Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
> Lời giải:
• Axit: là những chất phân li trong nước ra ion H+, ví dụ:
HCl → H+ + Cl-
H2S ⇌ 2H+ + S2-
• Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl-
• Axit nhiều nấc là những axit phân li nhiều lần ra H+ như:
| H2S là axit hai nấc |
H2S ⇌ H+ + HS- HS- ⇌ H+ + S2- |
| H3PO4 là axit ba nấc |
H3PO4 ⇌ H+ + H2PO4- H2PO4- ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |
• Bazơ là những chất khi tan trong nước phân li ra ion OH-
Ba(OH)2 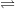 Ba2+ + 2OH-
Ba2+ + 2OH-
• Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
- Ví dụ: Zn(OH)2, Al(OH)3, Be(OH)2…
+ phân li kiểu bazơ: Al(OH)3 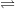 Al3+ + 3OH-
Al3+ + 3OH-
+ phân li kiểu axit: HAlO2 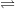 AlO2- + H+
AlO2- + H+
(Khi đó: Al(OH)3 viết dưới dạng axit HAlO2.H2O)
• Muối trung hoà: là những muối mà phân tử không còn khả năng phân li ra ion H+
- Ví dụ: NaCl, K2SO4, NaHPO3, CaCO3, Al(NO3)3 ,...
Al(NO3)3 → Al3+ + 3NO3-
• Muối axit: là muối mà trong phân tử vẫn còn hiđro có khả năng phân li ra ion H+
- Ví dụ: NaHSO4, NaHCO3, KH2PO4, K2HPO2 ,...
NaHSO4 → Na+ + HSO4-
- Gốc axit HSO4- lại phân li (yếu) ra H+
HSO4- 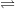 H+ + SO42-
H+ + SO42-
* Bài 2 trang 10 sgk hóa 11: Viết phương trình điện li của các chất sau:
a) Các axit yếu H2S; H2CO3
b) Bazơ mạnh: LiOH
c) Các muối: K2CO3, NaClO, NaHS
d) Hiđroxit lưỡng tính: Sn(OH)2
> Lời giải:
a) Các axit yếu H2S; H2CO3:
H2S 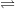 H+ + HS-
H+ + HS-
HS- 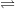 H+ + S2-
H+ + S2-
H2CO3 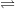 H+ + HCO3-
H+ + HCO3-
HCO3- 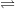 H+ + CO32-
H+ + CO32-
b) Bazơ mạnh LiOH
LiOH → Li+ + OH-
c) Các muối K2CO3, NaClO, NaHS
K2CO3 → 2K+ + CO32-
NaClO → Na+ + ClO-
NaHS → Na+ + HS-
HS- 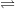 H+ + S2-
H+ + S2-
d) Hiđroxit lưỡng tính Sn(OH)2:
Sn(OH)2 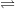 Sn2+ + 2OH-
Sn2+ + 2OH-
Hoặc H2SnO2 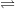 2H+ + SnO22-
2H+ + SnO22-
* Bài 3 trang 10 sgk hóa 11: Theo thuyết A-re-ni-ut, kết luận nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là một axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation H+ trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
> Lời giải:
- Đáp án: C. Một hợp chất có khả năngphân li ra cation H+ trong nước là axit.
A. Sai vì: axit là chất khi tan trong nước phân li ra H+( định nghĩa theo thuyết A-re-ni-ut). Nhiều chất trong phân tử có Hidro nhưng phải axit như: H2O, NH3,...
B. Sai vì: các hidroxit lưỡng tính trong thành phần phân tử cũng có nhóm OH: Zn(OH)2, Al(OH)3,...
D. Sai vì: Bazơ là chất khi tan trong nước phân li ra anion OH-, nên trong phân tử bazơ luôn có nhóm OH (định nghĩa theo thuyết A-rê-ni-ut).
* Bài 4 trang 10 sgk hóa 11: Với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M
B. [H+] < [CH3COO-]
C. [H+] > [CH3COO-]
D. [H+] < 0,10M
> Lời giải:
- Đáp án: D. [H+] < 0,10M
- Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần: CH3COOH 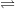 H+ + CH3COO-
H+ + CH3COO-
⇒ [H+] < [CH3COO-]= 0,1M
* Bài 5 trang 10 sgk hóa 11: Đối với dung dịch axit mạnh HNO3 0,10M nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M
B. [H+] < [NO3-]
C. [H+ ] < [NO3-]
D. [H+ ] < 0,10M
> Lời giải:
- Đáp án: A. [H+ ] = 0,10M
Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch:
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3- ] = 0,1M
Trên đây là phần hướng dẫn giải một số bài tập về axit, bazơ, muối và hidroxit lưỡng tính, với các bài 1, 2, 3, 4, 5 trang 10 SGK Hóa 11. Khoia.vn hy vọng qua nội dung này các em đã rèn luyện được khả năng nhận dạng bài toán để có phương pháp giải phù hợp.
Đánh giá & nhận xét
- Bài 2 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 61 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 61 SGK Vật lí 11 Chân trời sáng tạo


































