Bài tập Amoniac và Muối Amoni: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8 trang 37, 38 SGK Hóa 11 bài 8
Sau khi tìm hiểu về amoniac và muối amoni, biết được cấu tạo phân tử, tính chất vật lí, tính chất hóa học của amoniac và muối amoni. Cách điều chế, ứng dụng và vai trò của amoniac, muối amoni trong thực tiễn ở bài viết trước.
Nội dung bài viết này các em sẽ vận dụng kiến thức lý thuyết ở trên để giải một số bài tập Amoniac và Muối Amoni: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8 trang 37, 38 SGK Hóa 11 bài 8, qua đó rèn luyện được kỹ năng giải bài tập đồng thời giúp ghi nhớ kiến thức lý thuyết tốt hơn.
* Bài 1 trang 37 SGK Hóa 11: Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng amoniac tan nhiều trong nước?
> Lời giải:
• Thí ngiệm:
- Khí amoniac được nạp vào đầy bình thuỷ tinh, đạy bình bằng nút cao su có ống thuỷ tinh nhọn xuyên qua.
- Nhúng đầu ống thuỷ tinh vào chậu nước có pha vài giọt phenolphtalein.
- Hiện tượng: Nước dâng lên rất nhanh trong ống thuỷ tinh nhọn sau đó phun lên có tia màu hồng
- Giải thích: Khí amoniac tan rất nhanh trong nước là giảm áp suất trong bình nên áp suất ngoài không khí nén vào mặt thoáng của chậu nước làm nước phun lên trong ống thuỷ tinh thành dòng. Amoniac tan trong nước tạo thành dung dịch có tính bazơ làm cho phenolphtalein không màu chuyển thành màu hồng.
* Bài 2 trang 37 SGK hóa 11: Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
Khí A ![]() dung dịch A
dung dịch A ![]() B
B ![]() Khí A
Khí A ![]() C
C ![]() D + H2O
D + H2O
Biết rằng A là hợp chất của nitơ.
> Lời giải:
- Các phương trình phản ứng hóa học:
(1) Khí NH3 + H2O ![]() NH4OH
NH4OH
(2) NH3 + HCl → NH4Cl
(3) NH4Cl + NaOH → NH3↑ + NaCl + H2O
(4) NH3 + HNO3 → NH4NO3
(5) NH4NO3 → N2O↑ + 2H2O
* Bài 3 trang 37 SGK hóa 11: Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.Hãy viết phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac?
> Lời giải:
- Phương trình điều chế hiđro
CH4 + 2H2O CO2 + 4H2
- Phương trình loại khí oxi:
CH4 + 2O2 CO2 + 2H2O
- Phương trình tống hợp amoniac:
N2 + 3H2 ![]() 2NH3
2NH3
* Bài 4 trang 38 SGK hóa 11: Trình bày phương pháp hoá học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng đã dùng.
> Lời giải:
- Cho quỳ tím vào từng ống: ống màu xanh là dung dịch NH3; hai ống có màu hồng là NH4Cl và (NH4)2SO4; ống không có hiện tượng gì là Na2SO4.
- Cho Ba(OH)2 vào hai ống làm hồng quỳ tím. Nếu thấy ống nào có khí bay ra mùi khai là NH4Cl, ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
* Bài 5 trang 38 SGK hóa 11: Muốn cho cân bằng của phản ứng tổng hợp amoniac sang phải, cần phải đồng thời:
A. Tăng áp suất và tăng nhiệt độ.
B. Giảm áp suất và giảm nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất và tăng nhiệt độ.
> Lời giải:
• Chọn đáp án: C. Tăng áp suất và giảm nhiệt độ.
- Phản ứng điều chế NH3:
Chiều thuận: N2 + 3H2 ![]() 2NH3 (ΔH<0)
2NH3 (ΔH<0)
Chiều nghịch: N2 + 3H2 ![]() 2NH3 (ΔH<0)
2NH3 (ΔH<0)
- Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
- Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận).
* Bài 6 trang 38 SGK hóa 11: Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3 số oxi hoá của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá?
> Lời giải bài 6 trang 38 SGK hóa 11:
- Phương trình phản ứng nhiệt phân:
![]() (1)
(1)
![]() (2)
(2)
- Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.
- Ở cả hai phản ứng nitơ nguyên tử trong ion NH4+ đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).
- Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2- ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3-) xuống +1.
* Bài 7 trang 38 SGK hóa 11: Cho dung dịch NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.
a) Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn?
b) Tính thể tích khí (đktc) thu được?
> Lời giải:
a) Phương trình phản ứng:
2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
NH4+ + OH- → 2NH3↑ + H2O
b) Tính thể tích khí thu được
- Theo bài ra ta có: n(NH4)2SO4 = V.CM = 0,15.1 = 0,15 (mol).
- Theo PTPƯ: nNH3 = 2.n(NH4)2SO4 = 2.0,15 = 0,3 (mol).
⇒ VNH3 = nNH3.22,4 = 0,3. 22,4 = 6,72 (lít).
* Bài 8 trang 38 SGK hóa 11: Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
C. 22,4 lit N2 và 67,2 lit H2
D. 44,8 lit N2 và 67,2 lit H2
> Lời giải:
• Chọn đáp án: A. 44,8 lit N2 và 134,4 lit H2
N2 + 3H2 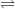 2NH3 (t0,xt,p)
2NH3 (t0,xt,p)
- Theo bài ta, nNH3 = 17/17 = 1(mol).
- Theo PTPƯ: nN2 = (1/2)nNH3 = (1/2).1 = 0,5 (mol).
nH2 = (3/2)nNH3 = (3/2).1 = 1,5 (mol).
- Do hiệu suất 25% nên
⇒ nN2 (cần dùng) = 2(mol) và nH2 (cần dùng) = 6(mol).
⇒ VN2 = 2.22,4 = 44,8 (lít)
⇒ VH2 = 22,4. 6= 134,4 (lít).
Trên đây KhoiA.Vn đã hướng dẫn các em cách giải một số Bài tập Amoniac và Muối Amoni: Giải bài tập 1, 2, 3, 4, 5, 6, 7, 8 trang 37, 38 SGK Hóa 11 trong nội dung bài học 8. Hy vọng bài viết giúp các em hiểu rõ hơn. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết, chúc các em thành công.
Đánh giá & nhận xét
- Bài 2 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 61 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 61 SGK Vật lí 11 Chân trời sáng tạo


































