Axit Nitric HNO3 tính chất hóa học, tính chất vật lý của axit Nitric, Muối Nitrat - Lý thuyết hóa 11 bài 9
Axit nitric HNO3 có nhiều ứng dụng quan trọng trong đời sống sản xuất như: sản xuất phân đạm NH4NO3, Ca(NO3)2,... hay sản xuất thuốc nổ TNT, thuốc nhuộm, dược phẩm,...
Vậy axit nitric HNO3 có tính chất hóa học, tính chất vật lý gì? được điều chế ra sao? tất cả sẽ có câu trả lời trong bài viết này.
A. Axit Nitric HNO3
I. Cấu tạo phân tử của axit nitric
- Axit nitric (HNO3) có công thức cấu tạo: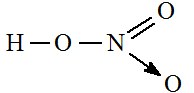
- Trong hợp chất HNO3, nitơ có số oxi hóa cao nhất là +5.
II. Tính chất vật lý của axit nitric HNO3
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
- Axit HNO3 tan vô hạn trong nước. Trong phòng thí nghiệm thường có loại HNO3 đặc nồng độ 68%, D = 1,40g/cm3.
- Axit nitric kém bền. Trong điều kiện thường, có ánh sáng, dung dịch axit đặc bị phân hủy 1 phần giải phóng khí nito dioxit, khí này lại tan trong dung dịch axit làm cho dung dịch có màu vàng
4HNO3 → 4NO2 + O2 + 2H2O
III. Tính chất hóa học của axit nitric HNO3
1. Axit nictric HNO3 là một trong các axit mạnh
- Làm quỳ tím hóa đỏ, tác dụng với bazơ và oxit bazơ, tác dụng với muối của axit yếu.
- Ví dụ: CuO + 2HNO3 → Cu(NO3)2 + H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
2. Axit nitric HNO3 là chất oxi hóa mạnh
• Axit nitric HNO3 phản ứng với hầu hết các kim loại trừ Pt và Au,
- Ví dụ: Cu + 4HNO3 (đặc) → Cu(NO3)2 + 2NO2 + 2H2O
* Axit nitric HNO3 tác dụng một số phi kim, nhiều hợp chất vô cơ và hữu cơ.
(Một số hợp chất hữu cơ bốc cháy khi gặp HNO3 đặc)
- Ví dụ: C + 4HNO3 (đ) CO2 + 4NO2 + 2H2O
3FeO + 10HNO3 (đ) → 3Fe(NO3)3 + NO + 5H2O
- Sản phẩm khử sinh ra tùy thuộc nồng độ axit, tính khử của kim loại và nhiệt độ phản ứng.
* Lưu ý: Al, Fe, Cr không phản ứng với HNO3 đặc nguội.
IV. Điều chế axit nitric HNO3
1. Điều chế axit Nitric HNO3 trong phòng thí nghiệm
Axit HNO3 được điều chế bằng cách cho NaNO3 hoặc KNO3 tác dụng với axit H2SO4 đăc, nóng:
2NaNO3(tt) + H2SO4(đ) Na2SO4 + 2HNO3
2. Điều chế axit Nitric HNO3 trong công nghiệp
- Trong công nghiệp axit nitric được sản xuất từ amoni qua 3 giai đoạn:
1- Oxi hóa khí amoniac bằng oxi không khí thành nitơ monooxit (NO):
4NH3 + 5O2 4NO + 6H2O
2- Oxi hóa nitơ monooxit thành nitơ đioxit bằng oxi không khí ở điều kiện thường:
2NO + O2 → 2NO2
3- Nitơ đioxit tác dụng với nước và oxi thành axit nitric:
4NO2 + O2 + 2H2O → 4HNO3
Để có axit nitric với nồng độ cao hơn 68%, người ta chưng cất axit này với H2SO4 đậm đặc.
B. Muối Nitrat
I. Tính chất vật lý của muối nitrat
- Tất cả các muối nitrat đều tan nhiều trong nước và là chất điện li mạnh.
II. Tính chất hóa học của muối nitrat
- Các muối nitrat kém bền với nhiệt, chúng bị phân hủy khi đun nóng
- Muối nitrat của các kim loại hoạt động mạnh đứng trước Mg (kali, natri,…) bị phân hủy thành muối nitrit và oxit
- Ví dụ: 2KNO3 2KNO2 + O2
- Muối nitrat của kim loại từ Mg đến Cu bị phân hủy thành oxit kim loại tương ứng, NO2 và O2
- Ví dụ: 2Cu(NO3)2 2CuO + 4NO2 + O2
- Muối nitrat của kim loại kém hoạt động (Sau Cu) bị phân hủy thành kim loại tương ứng, khí NO2 và O2.
- Ví dụ: 2AgNO3 2Ag + 2NO2 + O2
III. Nhận biết ion nitrat
- Trong môi trường axit, ion NO3- thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3- là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng.
- Hiện tượng: dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2NO3- → 3Cu2+ (dd màu xanh) + 2NO↑ + 4H2O
2NO + O2 (không khí) → 2NO2 (màu nâu đỏ)
IV. Ứng dụng của muối nitrat
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm) trong nông nghiệp như NH4NO3, NaNO3, KNO3.
- KNO3 còn được sử dụng để chế thuốc nổ đen (thuốc nổ có khói) chứa 75% KNO3, 10% S và 15% C.
C. Chu trình của nito trong tự nhiên
- Trong tự nhiên luôn luôn diễn ra các quá trình chuyển hóa nitơ từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín như hình sau:
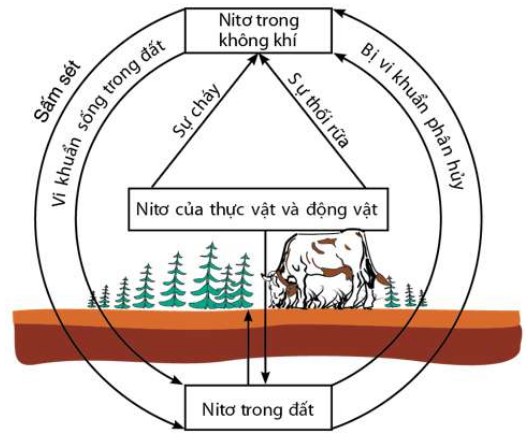 Chu trình của nito trong tự nhiên
Chu trình của nito trong tự nhiên
Đến đây các em đã tìm hiểu xong nội dung lý thuyết về axit nitric HNO3 và muối nitrat. Qua đó giải đáp được các câu hỏi như: axit nitric HNO3 có tính chất hóa học, tính chất vật lý gì? được điều chế và ứng dụng như thế nào? Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé,chúc các em thành công.
• Xem hướng dẫn giải bài tập Hoá học 11
> Bài 2 trang 45 SGK Hoá 11: Lập các phương trình hoá học?...
> Bài 5 trang 45 SGK Hoá 11: Viết phương trình hóa học của phản ứng thực hiện dãy chuyển hóa sau:...
Đánh giá & nhận xét
- Bài 2 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 61 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 61 SGK Vật lí 11 Chân trời sáng tạo


































