Bài 1 trang 10 SGK Hóa 11: Nội dung về Axit, Bazơ, Muối
Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit?...
Bài 1 trang 10 SGK Hóa 11: Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit? Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
Lời giải bài 1 trang 10 SGK Hóa 11:
• Axit: là những chất phân li trong nước ra ion H+, ví dụ:
HCl → H+ + Cl-
H2S ⇌ 2H+ + S2-
• Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl-
• Axit nhiều nấc là những axit phân li nhiều lần ra H+ như:
| H2S là axit hai nấc |
H2S ⇌ H+ + HS- HS- ⇌ H+ + S2- |
| H3PO4 là axit ba nấc |
H3PO4 ⇌ H+ + H2PO4- H2PO4- ⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |
• Bazơ là những chất khi tan trong nước phân li ra ion OH-
Ba(OH)2 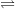 Ba2+ + 2OH-
Ba2+ + 2OH-
• Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
- Ví dụ: Zn(OH)2, Al(OH)3, Be(OH)2…
+ phân li kiểu bazơ: Al(OH)3 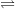 Al3+ + 3OH-
Al3+ + 3OH-
+ phân li kiểu axit: HAlO2 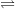 AlO2- + H+
AlO2- + H+
(Khi đó: Al(OH)3 viết dưới dạng axit HAlO2.H2O)
• Muối trung hoà: là những muối mà phân tử không còn khả năng phân li ra ion H+
- Ví dụ: NaCl, K2SO4, NaHPO3, CaCO3, Al(NO3)3 ,...
Al(NO3)3 → Al3+ + 3NO3-
• Muối axit: là muối mà trong phân tử vẫn còn hiđro có khả năng phân li ra ion H+
- Ví dụ: NaHSO4, NaHCO3, KH2PO4, K2HPO2 ,...
NaHSO4 → Na+ + HSO4-
- Gốc axit HSO4- lại phân li (yếu) ra H+
HSO4- 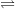 H+ + SO42-
H+ + SO42-
Trên đây Khối A đã hướng dẫn các em giải bài 1 trang 10 SGK Hoá 11. Nếu có câu hỏi hay góp ý các em hãy để lại bình luận dưới bài viết nhé, chúc các em thành công.
• Xem hướng dẫn giải bài tập Hoá học 11
> Bài 2 trang 10 SGK Hóa 11: Viết phương trình điện li của các chất sau...
> Bài 3 trang 10 SGK Hóa 11: Theo thuyết A-re-ni-ut, kết luận nào sau đây đúng?...
Đánh giá & nhận xét
- Bài 2 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 86 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 79 SGK Vật lí 11 Chân trời sáng tạo
- Bài 3 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 72 SGK Vật lí 11 Chân trời sáng tạo
- Bài 2 trang 61 SGK Vật lí 11 Chân trời sáng tạo
- Bài 1 trang 61 SGK Vật lí 11 Chân trời sáng tạo


































